H5N1
ET FAUNE SAUVAGE
Comme vous pourrez le constater, cette page ne concerne pas uniquement le H5N1 et la faune sauvage. Elle traite du sujet dans sa globalité, de manière à apporter à chacun les outils de compréhension relatifs à ce sujet, permettant ainsi de ne pas céder à la psychose générée par les médias !
Une fois de plus, la situation montre clairement le lien étroit entre faune sauvage et santé publique, et justifie d’autant la création de projets tels que portés par l’association Sibylline.
Qu’est–ce qu’un virus ?
Virus de la grippe A/H1N1 (« porcine », mexicaine)
Définition
Un virus est une entité biologique composé d’un acide nucléique, ADN (acide désoxyribonucléique) ou ARN (acide ribonucléique) : c’est le génome viral. L’ADN et l’ARN peuvent être mono ou bi–caténaire (simple ou double brin), à polarité positive (dans le même sens qu’un ARN messager) ou négative (complémentaire d’un ARN messager). La polarité positive est directement messagère donc directement traduisible par les ribosomes (petites usines d’assemblage des acides aminés en protéines). La polarité négative nécessite une étape préalable de transcription en ARN de polarité positive qui est le seul à être messager.
Ce matériel génétique qui porte toute l’information du virus est associée à une capside constituée de protéines. L’ensemble est appelé nucléocapside.
Il arrive que cette nucléocapside soit elle–même entourée d’une enveloppe ; enveloppe acquise en fin de cycle viral, par bourgeonnement, au détriment de la membrane plasmique (pour les virus à ARN) ou de la membrane nucléaire (pour les virus à ADN). Cette enveloppe détermine deux grandes familles de virus : virus nus et virus enveloppés.
Toutes les cellules (animales, végétales, bactéries) contiennent de l’ADN et de l’ARN, contrairement aux virus qui ne contiennent que l’un ou l’autre. Ces derniers ont donc besoin de parasiter une cellule VIVANTE (végétale, animale, bactérie) pour se multiplier, ce qui leur vaut la dénomination de parasites intracellulaires stricts.
Dans le milieu extérieur, le virus est sous la forme d’une particule : le virion, qui ne peut se reproduire (vu qu’il a besoin d’une cellule vivante). C’est une forme de dissémination passive (porté par le vent, l’eau, les chaussures, les roues de voiture, tout cela varie selon le virus, sa résistance dans le milieu extérieur…) qui représente un état statique et inerte. Il est donc en situation de survie.
C’est seulement après avoir pénétré dans la cellule que le virus entre dans sa phase dynamique : la multiplication.
Les mécanismes de réplication intracellulaire, conditionnés par les caractéristiques du génome (ADN ou ARN, nombre de brins, sens), déterminent les symptômes et les lésions observés.
Cycle de multiplication virale
Trois étapes caractérisent la multiplication d’un virus. On a déjà dit que le virus, pour se multiplier, avait besoin d’une cellule vivante. En effet, contrairement à une cellule, un virus ne possède pas, à lui seul, le matériel nécessaire pour se multiplier (fabriquer des protéines de capside, dupliquer son programme génétique pour autant de virions que nécessaire…). Il doit donc parasiter une cellule et détourner son matériel à SON profit, et ce, au détriment de la cellule qui ne fonctionne plus normalement (sorte de prise d’otage). Mais n’importe quel virus ne peut pas pénétrer dans n’importe quelle cellule. Il doit préalablement y avoir reconnaissance, et donc complémentarité, entre les deux entités. Tout se passe comme si la cellule possédait une serrure (un récepteur de membrane) que le virus devait ouvrir avec une clé (fixée à sa périphérie : protéine de capside pour les virus nus, glycoprotéines d’enveloppe pour les virus enveloppés, dites majeures).
Les récepteurs cellulaires sont caractéristiques à chaque espèce et, au sein d’une même espèce, à chaque type de cellule (sang, tube digestif…). L’absence de récepteurs sur la membrane des cellules de certaines espèces explique la résistance naturelle de ces espèces.
Conclusion : à chaque virus, son(ses) espèce(s) et son(ses) type(s) de cellules.
Les 3 phases plus en détail
1) Initiation Adsorption : le virus adhère à la surface de la cellule qu’il va infecter, par une rencontre au hasard. Le virus a d’autant plus de chances de rencontrer une cellule au hasard que le nombre de virus est important et que la quantité de cellules adsorbantes est suffisante.
Pénétration du génome viral à l’intérieur de la cellule
Décapsidation : libération totale ou partielle de l’acide nucléique.
2) Eclipse biochimique : phase au cours de laquelle on ne voit plus grand chose morphologiquement
Stade de fabrication de la plupart des constituants du virus. Après infection de la cellule par le virus, la cellule fabrique les différentes macromolécules virales et produit des virus, généralement en grande quantité.
3) Morphogenèse
Assemblage et maturation finale qui aboutit à la libération des virions néoformés.
Interactions virus–cellules
Trois types d’interactions peuvent être définis selon le devenir du génome viral à l’intérieur de la cellule cible.
Interaction productive, la plus classique : le virus pénètre à l’intérieur de la cellule et cela conduit à la libération de nouveaux virions fils à partir d’un seul virion parental, avec, ou non, mort de la cellule. On parle de cycle productif (productif car la cellule produit des virus) lytique ou non lytique.
Dans le cycle productif non lytique, il n’y a pas mort cellulaire et cela correspond le plus souvent à un état d’infection chronique avec établissement d’une sorte d’équilibre entre le virus et la cellule qui produit du virus pendant un temps généralement assez long mais sans mourir. Dans le cycle productif lytique, il y a mort de la cellule. Pour que les virions–fils soient libérés par la cellule–hôte, il est indispensable que la cellule éclate, ce qui aboutit à la mort cellulaire et à la libération d’un grand nombre de virions–fils dans le milieu extérieur.
Interaction abortive : ici, le virus est incapable d’exprimer l’ensemble de son programme génétique dans la cellule. Le virus peut éventuellement pénétrer à l’intérieur du cytoplasme (milieu intérieur de la cellule) mais à un moment ou à un autre du cycle, le processus de multiplication s’arrête : il y a blocage du système de multiplication du virus, d’où absence de production de virions et survie de la cellule. Ce type d’interactions est présent chaque fois qu’un virus se trouve en présence de cellules d’une autre espèce que la ou les espèces hôtes naturels. Les cellules sont éventuellement réceptives mais non permissives et ne permettent pas l’expression du programme génétique complet du virus, contrairement au cycle productif où les cellules sont réceptives et permissives.
Interaction intégrative : dans ce type d’interaction, le génome viral s’intègre à l’intérieur du génome de la cellule, en s’y liant. Les deux génomes sont alors en association intime qui peut persister au cours des générations : lorsque la cellule va se diviser, toute sa descendance va posséder l’information génétique du virus. Ce génome viral intégré est appelé provirus, état de « dormance » qui peut donc persister à vie chez l’individu infecté, sans symptômes. Le provirus peut récupérer la capacité de repasser à un stade productif avec fabrication de virions déclenchant ainsi des symptômes cliniques, parfois très longtemps après la contamination. C’est le cas, par exemple, des herpesvirus.
Au final, il faut retenir que l’entrée d’un virus dans une cellule n’est pas obligatoirement synonyme de maladie.
Les virus grippaux
Ils appartiennent aux myxoviridæ et plus précisément à la famille des Orthomyxoviridæ, genre influenza. L’on en distingue trois types : A, B et C.
|
Type de virus
|
Espèces cibles
|
Classe d’âge
|
Caractéristiques
|
Réservoir naturel
|
|
A
|
Humain et animal 3 sous–types chez l’homme : H1N1, H2N2, H3N2 |
Toutes
|
Peut être responsable de grandes épidémies Nombreux sous–types : 16 HA et 9 NA |
Oiseaux
|
|
B
|
Humains seulement
|
Enfants
|
Faiblement épidémique
|
.
|
|
C
|
Rarement observé chez les humains et les porcs
|
.
|
Non épidémique
|
.
|
Virus de la grippe aviaire
Constitution
On qualifie de « virus influenza A aviaire », un virus isolé chez un oiseau ou dont les séquences de gènes sont semblables à celles qui circulent habituellement chez les oiseaux et référencées comme telles dans des banques de données.
Les virus influenza A sont des virus à ARN, enveloppés, mesurant de 80 à 120 nm de diamètre.
L’ARN génomique est toujours constitué de 8 segments d’ARN monocaténaire de polarité négative, associés à l’intérieur de la nucléocapside. Les trois plus gros ARN génomiques codent pour les protéines à fonction de transcriptase et de réplicase, deux autres codant pour les protéines d’enveloppe (HA et NA), deux autres pour la protéine de capside et une protéine matricielle d’assemblage, le huitième segment codant, dans deux cadres de lecture différents, pour de petits polypeptides mal connus. 8 segments donnent 10 protéines.
Deux protéines membranaires : l’hémagglutinine (HA, environ 40% des glycoprotéines de surface) et la neuraminidase (NA) sont particulièrement importantes car impliquées dans la fixation au récepteur cellulaire et la dissémination virale. La fonction de la neuraminidase (N-acetyl-neuraminyl-hydrolase, sialidase présente sous la forme d’homotétramères) reste mal connue : elle permettrait la libération de virions néoformés, serait impliquée dans la progression du virus dans les voies respiratoires et favoriserait la fusion des membranes virales et cellulaires au cours de la phase de pénétration du virus.
Le terme d’hémagglutinine vient de la capacité de cette glycoprotéine à agglutiner les hématies de certaines espèces animales, capacité qui assure une protection au virus ; celui-ci, « caché » dans les cellules sanguines, échappe aux réactions de défense de l’hôte. Cette propriété est utilisée dans les tests diagnostiques basés sur la recherche d’anticorps bloquant l’hémagglutination.
A ce jour, seize types antigéniques différents d’hémagglutinine et neuf types de neuraminidase ont été identifiés chez les oiseaux. La seizième hémagglutinine a été découverte chez la mouette rieuse (Larus ridibundus) en Suède. La combinaison de ces deux glycoprotéines permet de définir des sous–types de souche virale, notés HmNn (ex : H5N1).
En théorie, toutes les combinaisons sont possibles vu que chaque virus porte un antigène HA et un antigène NA. En pratique, toutes n’ont pas été observées chez les oiseaux sauvages, réservoir naturel du virus.
La nomenclature des virus grippaux est la suivante : type/espèce/lieu d’isolement de la souche virale/ numéro de la souche/année d’isolement (sous-type). Le terme « H5N1 » est donc très réducteur. Ainsi, actuellement, différentes souches virales circulent sous le même nom malgré des pouvoirs pathogènes très variables.
Exemple : souches A/chicken/Shantou/423/2003(H5N1) et A/bar-headed goose/ Qinghai/5/2005(H5N1), toutes deux H5N1.
Facteurs de virulence
Le même virus grippal aviaire peut exister sous deux formes différentes, l’une hautement pathogène (IAHP) et l’autre faiblement pathogène (IAFP). La différence entre les deux s’explique par une mutation au niveau de la séquence du gène qui code pour le site de clivage de l’hémagglutinine. Pour être fonctionnelle (favoriser la pénétration du virus dans la cellule hôte), l’hémagglutinine doit être clivée (rupture du pont disulfure) en deux sous-unités HA1 et HA2, par des protéases, au niveau d’acides aminés basiques. Or certaines hémagglutinines ont une constitution particulière qui facilite le clivage des deux sous-unités. Dans ce cas, les acides aminés sont reconnus par une enzyme présente dans de multiples cellules de l’organisme, ce qui assure la dissémination virale. Cette augmentation de la virulence, en fonction du nombre et du type d’acides aminés présents au niveau du site de clivage, selon les souches de virus, a pu être démontré chez le poulet. Elle concerne les sous-types H5 et H7.
La neuraminidase et d’autres éléments structuraux et gènes (présence essentielle d’un acide glutamique à la position 92 de la protéine virale non structurale NS1, raccourcissement de la neuraminidase, substitutions au niveau du gène de la protéine basique PB2…) sont certainement impliqués dans l’acquisition de la virulence de certaines souches du virus (études chez le porc).
Il faut signaler que les sous–types H5 et H7 NE sont PAS TOUS hautement pathogènes, notamment pour l’influenza A(H5N1) mis en cause actuellement. Les autres sous–types (H1 à H4, H6 et H8 à H16) peuvent causer des troubles de la santé chez les oiseaux domestiques. Toutefois, la maladie engendrée par ces derniers sous–types se répand beaucoup plus lentement que dans le cas des sous–types H5 et H7 hautement pathogènes.
Le pouvoir de pathogénicité (mesure de la gravité de la maladie) se détermine à l’aide d’un indice : l’IPIV (indice de pathogénicité par voie intraveineuse). Les souches hautement pathogènes ont un IPIV supérieur à 1,2 (référence : poulet EOPS âgé de 6 semaines).
Affinité du virus vis–à–vis de l’hôte
Elle est déterminée au niveau moléculaire par la neuraminidase et l’hémagglutinine, protéines à la base du typage H et N.
L’hémagglutinine (la clé, rappelez–vous) est impliquée dans l’attachement du virus sur les récepteurs cellulaires (la serrure). Ainsi, les virus grippaux humains se lient préférentiellement à des acides sialiques de type X (pour simplifier), majoritaires au niveau des cellules humaines, et les virus aviaires à des acides sialiques de type Y, prépondérants au niveau des cellules aviaires. La neuraminidase, responsable de l’hydrolyse du récepteur à l’hémagglutinine (coupe la liaison entre les acides sialiques récepteurs du virus portés par la cellule et la membrane cellulaire), est active spécifiquement sur un certain type de récepteurs, V ou W, selon qu’elle est d’origine aviaire ou humaine. Enfin, la nucléoprotéine, la protéine PB2 (protéine basique 2), les protéines impliquées dans la réplication sont également des déterminants de la restriction d’hôte.
Mutations
La caractéristique principale des virus grippaux est leur grande variabilité antigénique. Ils sont très instables car ils répliquent mal leur génome : ce sont de « mauvais élèves ». En fait, ils n’ont pas les systèmes de réparation des erreurs de copie dont disposent les virus plus sophistiqués ou les cellules des organismes évolués. De petites erreurs surviennent constamment au hasard : on ne peut donc prédire l’apparition de mutations spécifiques des virus grippaux, ni leur évolution. Les erreurs dans les gènes codant la neuraminidase et l’hémagglutinine sont les plus fréquentes.
Il existe deux types de variations antigéniques dont les mécanismes diffèrent :
- la variation dite majeure ou cassure antigénique (antigenic shift) – la variation dite mineure ou glissement antigénique (antigenic drift)
1er mécanisme : la cassure
Elle a été mise en évidence dans le type 1 de Myxovirus influenzæ et est caractérisée par l’apparition brusque, dans une population humaine ou animale, d’un virus extrêmement différent des souches antérieures, sur le plan antigénique. La variation antigénique majeure (on parle aussi de réassortiment génétique) conduit à l’apparition d’un nouveau sous–type, susceptible (mais ce n’est pas obligatoire) de s’adapter à l’homme et qui pourrait alors provoquer une épidémie, voire une pandémie car le virus ne trouverait aucune immunité correspondante pour limiter son extension. Pour comprendre ce phénomène, voir le chapitre sur la défense d’un organisme contre un agent infectieux.
Deux hypothèses :
1) Echange partiel d’information génétique entre deux virus grippaux (dont l’un défectif) infectant une même cellule (cas de co–infection). Il y aurait alors cassure puis recombinaison entre gènes H et/ou N de virus humain et virus animaux.
2) Recombinaison génétique entre un virus humain et un virus d’origine animale, facilitée par un hôte intermédiaire (ex : le porc) sensible à la grippe aviaire et à la grippe humaine.
2ème mécanisme : le glissement antigénique ou dérive génétique
La variation mineure, observée aussi bien parmi les virus de type B que A, est caractérisée par des modifications progressives des structures antigéniques (principalement de surface), les nouveaux variants révélant toujours leur parenté avec les souches immédiatement antérieures. Les variations antigéniques mineures donnent naissance à des épidémies hivernales.
En résumé, les mutations sont nombreuses et ne conduisent pas nécessairement au pire. Les mutations majeures, celles à craindre pour une hypothétique pandémie, sont favorisées par la promiscuité inter–espèces.
Il est impossible de prévoir si le H5N1 pourra un jour se transmettre rapidement et facilement d’un homme à l’autre, ni quand ?
Expression clinique de la grippe chez les oiseaux
La dénomination de peste aviaire est généralement limitée aux formes classiques à forte mortalité (suraiguës et aiguës principalement), les autres formes, dues à des virus peu pathogènes, étant qualifiées de grippe aviaire.
Formes cliniques :
Suraiguës et aiguës : le délai d’incubation est de 2 à 3 jours (jusqu’à 14 jours) avec une mortalité de 50 à 80 % en 24 à 72 heures. Baisse des consommations, prostration, chute de ponte (œufs décolorés et déformés), œdèmes de la tête, troubles respiratoires sévères, hémorragies sous-cutanées (crête, barbillons, pattes et bréchet), diarrhées et potentiels troubles neurologiques sont les symptômes de l’IAHP. Seuls ou diversement associés, ils varient en fonction des espèces. Le tableau clinique est quasiment identique à celui de la maladie de Newcastle. Seul un diagnostic de laboratoire permet de faire la différence.
Remarque : également appelée pseudo-peste aviaire, la maladie de Newcastle, zoonose mineure, affecte aussi les oiseaux mais elle est due à un virus différent de l’influenza : paramyxovirus aviaire de type 1.
Subaiguës : atteinte de l’état général, symptômes respiratoires et chutes de ponte. La mortalité peut être élevée.
Frustes : légers symptômes respiratoires et problèmes de ponte
Asymptomatiques : aucune expression de la maladie, fréquentes
La plupart des virus de l’influenza aviaire sont des formes faiblement pathogènes qui provoquent peu ou pas de signes cliniques chez les oiseaux infectés.
Législation
La grippe aviaire est une MRC (maladie réputée contagieuse) sous la dénomination « l’influenza sous toutes ses formes » (décret du 16 Août 1965 modifié par le décret du 27 Février 1995). « La maladie doit être provoquée par tout virus influenza de type A ayant un indice de pathogénicité par voie intraveineuse (I.P.I.V.) supérieur à 1,2 (chez le poulet EOPS âgé de 6 semaines) ou toute infection causée par des virus influenza de type A et de sous–type H5 ou H7 pour lesquels le séquençage des nucléotides a prouvé la présence d’acides aminés basiques multiples au niveau du site de coupure de l’hémagglutinine »
Les mesures de police sanitaire spécifiques sont fixées par l’arrêté du 8 Juin 1994. En cas de foyer, un APPDI (Arrêté Préfectoral Portant Déclaration d’Infection) délimite un périmètre infecté comprenant une zone de séquestration (exploitation atteinte) et des zones de protection et de surveillance (respectivement 3 km et 10 km, au minimum, autour de la zone de séquestration).
Résistance du virus dans le milieu extérieur
Les influenza virus sont particulièrement résistants dans les tissus et l’environnement (notamment dans l’eau) et peuvent survivre plus de 30 jours à 0°C et indéfiniment dans le cas de matières congelées. L’excrétion des virus influenza est importante par voie cloacale, contaminant ainsi les eaux de surface. La survie du virus dans les eaux douces de surface peut être de plusieurs semaines. A l’inverse, les virus influenza sont particulièrement sensibles à l’acidité, au sel, aux U.V. et à la chaleur : ils ne survivent pas plus de 5 minutes à 60°C et 1 minute à 100°C. L’enveloppe du virus de la grippe, de par sa structure phospholipidique, lui confère une sensibilité aux détergents et aux solvants des lipides. Les virus grippaux actuels, eu égard aux autres virus, sont considérés comme peu résistants ; comprendre qu’il ne faut pas déployer un arsenal dantesque pour s’en débarrasser.
Transmission du virus
La transmission verticale (à la descendance) n’est pas établie, même si l’on a pu mettre en évidence la contamination d’œufs au cours d’une épidémie de grippe aviaire en Pennsylvanie.
Prophylaxie
Tout d’abord quelques précisions d’ordre général
La prophylaxie regroupe celle sanitaire et celle médicale.
Prophylaxie sanitaire : c’est l’ensemble des mesures mises en œuvre pour prévenir la naissance des maladies contagieuses, en limiter et en arrêter la diffusion et en poursuivre l’éradication. Elle concerne toute la pathologie animale, infectieuse, parasitaire, tout ce qui représente une menace pour la santé animale, et humaine par voie de conséquence.
Prophylaxie médicale : c’est l’ensemble des mesures destinées à empêcher l’apparition ou la propagation d’une ou plusieurs maladies.
La prophylaxie sanitaire élimine les causes tandis que la prophylaxie médicale augmente la résistance aux (et non des) agents microbiens. On lui associe souvent des méthodes de prophylaxie sanitaire.
La vaccination relève du domaine de la prophylaxie médicale. Son but est de permettre à l’organisme la mise en place d’un système de défense face à l’agent pathogène considéré, lui assurant le contrôle du processus infectieux dès son installation. En résumé, il faut éliminer les ennemis quand ils sont les moins nombreux. Cependant, l’individu a pu éliminer le germe avant la mise en place, bien que très rapide, de la protection.
Epidémiologiquement, pour une population, elle permet d’atteindre un statut sanitaire suffisant pour que la prophylaxie sanitaire ne soit pas trop lourde à appliquer.
Défense d’un organisme contre un agent infectieux
Un organisme vivant, en bonne santé, acquiert la capacité, tout au long de sa vie, à reconnaître ce qui ne lui appartient pas et à lutter contre : reconnaissance du « non soi » par rapport au « soi ». Dès le premier contact avec l’agent étranger, il va déployer un mécanisme de défense basé sur le système immunitaire qui aboutira, si tout se passe bien, à son élimination.
Deux mécanismes entrent en jeu, l’un basé sur des défenses immunitaires non spécifiques, l’autre sur des défenses immunitaires spécifiques.
Les défenses non spécifiques
Premiers soldats sur le front, ils servent à contenir l’attaque et ne font pas dans le détail ; « leur but » : digérer, au sens propre du terme, l’ennemi. Ils sont identiques quel que soit l’agent en cause : bactéries, virus, parasites, champignons… et sont plus efficaces envers les bactéries.
Les défenses spécifiques
Deuxième bataillon à entrer en scène lorsque l’assaillant n’est pas maîtrisé : les défenses spécifiques, ainsi appelées car dirigées vers un agent pathogène donné et plus spécifiquement vers un constituant de cet agent pathogène (ex : l’hémagglutinine H5 du virus H5N1). Elles sont d’autant plus efficientes qu’elles sont rapidement mises en place.
Lorsque l’organisme est infecté pour la première fois par un agent pathogène donné, celui–ci a le temps de se multiplier avant que la défense spécifique ne soit fonctionnelle.
En revanche, si ce même agent étranger se représente quelques temps plus tard, il va provoquer une riposte plus rapide que la première fois car le système immunitaire garde en mémoire ce qui s’est déjà passé. La stratégie gagnante, pour se débarrasser du « non soi », est d’aller plus vite que l’assaillant. Le premier contact préalable est donc primordial. Et c’est sur ce principe que repose la vaccination. En effet, on injecte à un individu, qui n’a théoriquement jamais été en présence du germe contre lequel on veut le protéger, l’agent infectieux contre lequel on veut induire une réaction et donc une mémoire immunitaire. Ce qui injecté est transformé (rendu inoffensif) afin de ne pas provoquer de maladie chez l’individu.
Vaccination anti-virale (mais ceci est également applicable, dans le principe, pour les bactéries, champignons et parasites)
En l’absence de vaccination, si des individus ont déjà été en contact avec une souche particulière de virus, ils se retrouvent immunisés vis–à–vis de celle–ci, pendant une durée plus ou moins longue selon le virus.
La couverture vaccinale n’est plus aussi efficace si le virus a évolué. La mutation par glissement génétique entraîne des variations antigéniques, discrètes et continues, qui ne modifient pas la structure antigénique globale du virus. Elles assurent la conservation d’une immunité partielle, à court terme, et non totale car la mémoire immunitaire ne reconnaît plus strictement le virus.
Ex de la grippe : pour s’adapter aux nouveaux variants qui circulent, il faut renouveler chaque année la composition du vaccin tout en conservant les souches précédentes. Remarque : la protection est acquise au minimum 15 jours après l’injection, temps nécessaire au système immunitaire pour se constituer une mémoire.
Certaines vaccinations protègent contre plusieurs virus de la même famille. Pour cela, il faut que l’immunité stimulée le soit à l’égard d’un constituant d’un antigène, de préférence à fort pouvoir immunogène, commun à tous les virus. Actuellement, les vaccins anti-influenza sont basés sur l’antigène de surface H, antigène qui varie d’une souche à l’autre. On dit que le pouvoir immunogène est limité au sous–type correspondant : il y absence de protection croisée. La Belgique (chercheurs de l’Institut inter-universitaire flamand de biotechnologie (VIB), associés à l’université de Gand) tente de mettre au point un vaccin dirigeant l’immunité contre la protéine d’enveloppe M2 (rôle de canal à ions : son activation permet la libération du contenu du virus dans la cellule), commune à toutes les souches, ce qui permettrait une protection croisée (on parle aussi de vaccin universel). Les tests ont donné de bons résultats chez la souris. Cela est moins avantageux, économiquement, pour les laboratoires pharmaceutiques car la protection induite ne serait pas à renouveler chaque année (cas de la grippe humaine) ; les doses vendues le seraient donc en moins grande quantité.
Les grandes catégories de vaccines
- à germe inactivé : l’agent pathogène est tué (vaccins bactériens, viraux)
- à germe vivant : l’agent pathogène est manipulé pour diminuer son pouvoir pathogène (vaccins bactériens, viraux, parasitaires). Le germe assure lui–même la production d’antigènes car il se multiplie tout seul. L’on doit s’assurer que la souche est vraiment atténuée et que ce caractère est stable.
- Autre catégorie : anatoxines bactériennes.
Différents types de vaccins
1) Vaccins classiques
On introduit le germe entier
2) Vaccins sous–unités
Quel que soit l’agent, sa pathogénicité est liée à des fragments du germe (facteurs d’adhésion…) et non au germe entier. Il suffit donc de protéger contre l’un de ces facteurs pour protéger contre la maladie qu’elle provoque. Il est donc nécessaire de repérer les structures pathogènes et de les purifier afin de n’obtenir que l’antigène vaccinal, celui qui induira une réponse immunitaire. Cette technique permet d’éviter le gaspillage des ressources du système immunitaire.
Les résultats obtenus sont meilleurs qu’avec les vaccins à germe entier. Ils ne s’emploient que pour les vaccins inactivés.
3) Vaccins synthétiques ou recombinants
Ils sont directement liés au progrès de la biologie moléculaire et au génie génétique. Le principe est de faire produire à un virus Y le caractère antigénique (une protéine) d’un virus Z en intégrant l’information génétique Z (qui code pour cette protéine) à l’intérieur du génome de Y. Y, le vecteur vivant, est donc génétiquement modifié.
Le vecteur le plus utilisé est le virus de la variole aviaire car il représente des caractéristiques intéressantes : gros virus possédant un génome important (150 à 200 gênes) dans lequel il est relativement facile d’intégrer une portion de gêne étranger. Le virus recombinant obtenu doit donc exprimer la protéine codée.
Jusqu’à présent, dans le cas du virus grippal, on a pu faire exprimer à la surface du virus de la variole l’hémagglutinine H5 ou H7. D’autres virus peuvent également être utilisés comme vecteur : virus de la laryngotrachéite infectieuse (famille des HERPESVIRIDÆ). Ces vaccins n’induisent pas la production d’anticorps contre les neuraminidases, facilitant ainsi la différenciation entre les oiseaux vaccinés et les oiseaux naturellement infectés. Lorsque les virus utilisés comme vecteurs sont endémiques dans une région, la vaccination s’avère inefficace chez les animaux possédant déjà des anticorps contre le virus vecteur. En clair, leurs défenses naturelles va les débarrasser du virus vivant vectorisé et du même coup des antigènes portés par ce virus qui devaient leur faire produire des anticorps.
Une autre condition à cette technique vaccinale : le virus vivant vectorisé doit pouvoir se répliquer à l’intérieur de l’organisme dans lequel il est injecté. Cela n’est pas toujours possible : cas du dindon qui ne multiplie pas le virus de la laryngotrachéite infectieuse.
Par ailleurs, il faut tenir compte de la capacité de réplication du virus recombinant, variable selon les espèces.
Actuellement, l’Union Européenne n’a pas accordé de licence d’utilisation à ce type de produit ; le Mexique, à l’opposé, l’a employé lors d’une campagne de vaccination (vaccin recombinant vectorisé H5) menée contre le virus H5N2 faiblement pathogène.
En Europe, seuls sont autorisés les vaccins hétérologues (inactivés), qui, à la différence des vaccins homologues, ne contiennent pas la même souche virale que le virus responsable de l’épidémie. Lors d’une sérologie (permettant la recherche d’anticorps dirigés contre les antigènes du virus), cela permet de différencier les animaux vaccinés de ceux naturellement infectés.
Dans les pays de la CEE, la vaccination, lors des situations d’urgence, était limitée par l’incapacité à différencier les animaux vaccinés et ayant subi une précédente infection de ceux vaccinés et n’ayant jamais été infectés. En effet, il n’était pas possible d’identifier les anticorps induits par la vaccination de ceux induits par le contact avec l’agent infectieux lui–même.
La principale inquiétude était alors que la maladie ne se propage davantage par le biais du commerce ou du transfert d’animaux vaccinés ou de produits tirés de ces animaux, ou encore que la maladie ne se diffuse dans d’autres pays puisqu’il n’était pas possible d’établir si les animaux vaccinés avaient été exposés, sur le terrain, à l’agent pathogène.
Alternatives pour différencier les animaux infectés de ceux vaccinés
1) Sentinelles : dans un troupeau, un nombre restreint d’animaux ne sont pas vaccinés, témoins qui développeront théoriquement la maladie si elle est présente et qui permettront de repérer la présence du virus dans le milieu.
2) Utilisation de vaccins hétérologues Ils diffèrent des vaccins homologues par le fait que la souche utilisée pour le vaccin exprime la même hémagglutinine (type H) que la souche impliquée dans l’infection sur le terrain, mais ne possède pas la même neuraminidase (type N). Ainsi, suivant une exposition naturelle au virus, la protection contre la maladie clinique et la réduction de l’excrétion virale sont assurés par la réponse immunitaire induite par l’hémagglutinine homologue du vaccin, alors que les anticorps contre la neuraminidase de la souche responsable de l’infection peuvent être utilisés comme marqueur d’infection.
Politique vaccinale
La vaccination concerne les animaux réceptifs, exposé au risque et immunocompétents (n’ayant pas leur immunité diminuée par certaines maladies ou traitements). Ex de la rage : tous les animaux sont réceptifs mais tous ne sont pas dans une zone à risque.
Le choix doit être adapté à chaque infection car il existe une très grande diversité des espèces, des animaux réceptifs et des infections elles–mêmes. Il dépend de facteurs épidémiologiques, cliniques et économiques, avec une interdépendance de ces facteurs. La vaccination est réservée aux populations cibles pour lesquelles le coût de la vaccination est inférieur à l’argent dépensé pour soigner la maladie.
La réponse immunitaire est meilleure, au sein d’une population, lorsqu’il y a un rappel, en particulier pour les vaccins inactivés. En effet, la réponse immunitaire varie selon les individus (lors d’une première injection, il y a toujours un pourcentage d’animaux ne réagissant pas ; au fur et à mesure des rappels, ce pourcentage diminue).
Avantages de la vaccination
Le but de la vaccination est de limiter l’expression clinique de la maladie et le risque infectieux
Notion de risque infectieux : pour qu’un individu soit contaminé, il faut qu’il soit en contact avec un ou plusieurs sujets contaminés, eux mêmes porteurs de suffisamment de particules infectieuses, exception faite des agents très pathogènes : une petite quantité suffit alors (ex : une à deux pasteurelles donnent une septicémie mortelle). Généralement, cette quantité est de l’ordre de (10)6, (10)7 pour obtenir une expression clinique.
Si la personne vaccinée est exposée à l’agent contre lequel elle est vaccinée, deux cas de figure :
o le virus est combattu très efficacement ; il ne se développe pas dans l’organisme et la personne protégée n’aura aucun symptôme. L’excrétion de virions dans le milieu extérieur est nulle. o le virus parvient à se développer dans l’organisme mais les symptômes déclarés sont de moindres durée et intensité par rapport à un individu non vacciné. La vaccination permet l’atténuer des effets du virus et une excrétion virale moins importante et moins longue.
Inconvénients de la vaccination
Pseudo–disparition de la maladie : sous la pression vaccinale, il peut y avoir modification des caractères du virus et par voie de conséquence, possibilité d’échappement. Ex : la peste porcine provoquait une mortalité systématique. Lorsque l’on a entrepris une prophylaxie médicale, le virus a continué de circuler à bas bruit avec des formes cliniques très difficiles à reconnaître.
La plupart des vaccins protègent vis–à–vis de la manifestation clinique (la maladie) mais ne garantissent pas contre l’infection (la multiplication de l’agent infectieux). Un individu vacciné peut donc excréter des virus pathogènes sans pour autant être malade. Il est donc possible de protéger mais pas d’éradiquer la maladie. Il y a même contradiction entre éradication et vaccination.
Virus influenza et faune
Virus influenza et faune sauvage
La faune sauvage est actuellement désignée comme l’ennemi à abattre, responsable de tous nos maux. Le raccourci, certes facile, est quelque peu fourvoyant.
Avant toute chose, il peut paraître nécessaire d’effectuer un état des lieux par un tour d’horizon des espèces susceptibles d’héberger l’ennemi public n° 1.
Oiseaux
En France, les études menées de 1977 à 1999 en Baie de Somme, sur l’avifaune aquatique ont mis en évidence 93 souches de virus et l’existence d’un réservoir sauvage permanent. Entre 2000 et 2003, le virus influenza faiblement pathogène ou non pathogène a été identifié sur des oiseaux de la Dombes et de l’Estuaire de la Loire, notamment chez le canard colvert (Anas platyrhynchos), le foulque macroule (Fulica atra), le grand cormoran (Phalacrocorax carbo) et la sarcelle d’hiver (Anas crecca). Les connaissances sur le virus H5N1 sévissant dans les pays d’Europe de l’Est ne permettent pas de préciser exactement quelles sont les espèces d’oiseaux sensibles à ce virus. Dans le nord de la Chine, en Mongolie et en Russie, depuis Juin 2005, le virus H5N1 a été responsable de la mort d’oies, tadornes, mouettes, goélands et cormorans.
Toutes les espèces d’oiseaux sont considérées comme potentiellement (ce n’est donc pas une obligation) aptes à porter le virus avec une sensibilité variable des espèces selon les souches de virus. Le portage par les espèces est également à rapprocher des milieux de vie : la résistance du virus dans l’air est inférieur par rapport à celle dans l’eau douce.
Mammifères
Mammifères marins : cas des pinnipèdes
Deux épidémies attribuées à des souches aviaires décimèrent des centaines de phoques communs sur les côtes de la Nouvelle Angleterre. La première eut lieu en 1979-1980 avec la mortalité de plus de 600 animaux tandis que la deuxième apparut de Juin 1982 à Août 1983. L’hémagglutinine (H3) mise en cause appartient aux virus qui infectent les oiseaux du nord de l’Amérique. Depuis, de nouvelles vagues de mortalité imputées à de nouvelles souches de virus réapparaissent régulièrement. Au final, plus de 4 sous-types ayant été trouvés chez le phoque, cet animal peut aussi jouer le rôle de réservoir où les réassortiments génétiques viraux surviennent.
Pour expliquer le franchissement de la barrière inter-espèce, souvent entre des classes d’animaux très différentes – ici les mammifères et les oiseaux – l’hypothèse la plus fréquemment admise est la promiscuité entre deux espèces, l’une infectante, l’autre infectée.
Les pinnipèdes se seraient contaminés par le biais des fientes d’oiseaux marins rejetées dans les eaux intertidales où les phoques s’ébattent. Les phoques ne sont pas les seuls mammifères marins à connaître la grippe. Une liste plus exhaustive inclut les morses, les otaries, les baleines et autres cétacés.
Autres
Côté terrestre, souris, furets, visons, chameaux… ne sont pas en reste.
Des infections expérimentales en laboratoire ont confirmé la sensibilité de certains mammifères : macaque crabier (Macaca fascicularis, aussi appelé macaque de Java, macaque à longue queue ou macaque de Buffon, originaire d’Asie du Sud-Est), lapin blanc de Nouvelle Zélande, furet, souris et rat.
Le virus H5N1 hautement pathogène qui circule depuis 2003 a été mis en évidence lors d’infection naturelle chez quelques espèces de carnivores captifs ou semi-domestiqués : tigre, léopard, panthère nébuleuse, civette d’Owston.
Le virus H5N1 à été isolé chez une grande diversité d’espèces sauvages et toutes sont, a priori, susceptibles d’en être malade ou porteur asymptomatique.
Le mode de vie influence la transmission. La dilution de l’agent pathogène n’est pas permise en milieu confiné (élevages, zoos) comme elle l’est au sein des populations sauvages.
Animaux domestiques
Volailles d’élevage
La maladie est surtout décrite chez les espèces domestiques, en particulier le poulet, la dinde, la pintade, le faisan, la perdrix et la caille. Les palmipèdes sont très peu sensibles mais multiplient le virus. Le pigeon serait plutôt résistant.
En dépit du traité de Rio sur la biodiversité, les pays n’ont donné aucune priorité à la conservation de la diversité génétique chez les animaux de rente. Les millions d’oiseaux tués pour limiter l’extension du H5N1 depuis 2003, sans la création en parallèle d’un conservatoire génétique mondial, n’a de cesse de contribuer à l’appauvrissement d’un patrimoine très lentement renouvelable.
Pour des raisons économiques, la sélection intensive favorise des animaux uniformes génétiquement, présentant des caractères transmissibles d’une génération à l’autre. Cela garantit une conduite de lots homogènes (contraintes d’élevage) et des qualités zootechniques, le tout répondant au diktat de la rentabilité (perspective de rendement optimal) et du consommateur (caractères gustatifs, taux de matière grasse déterminé…). La sélection de résistances à une ou plusieurs maladies, alors qu’elles sont d’origine virale, relève de l’exploit connaissant la lenteur du processus comparé aux capacités évolutives des virus, notamment à ARN.
D’un point de vue zootechnique, l’agriculture biologique produit des volailles élevées en extérieur et bénéficiant de plus d’espace que leurs homologues élevés en bâtiments mais une partie croissante de la filière est dépendante de la fourniture de poussins d’un jour, issus de souches drastiquement sélectionnées.
Dans le cas de la grippe aviaire, comme dans le cas de tous les agents pathogènes transmis par voie aérienne, les conditions environnementales liées au mode d’élevage intensif : humidité et densité de population, sont propices à la dissémination du virus porté par les aérosols. Par ailleurs, dès qu’un animal est atteint, tous les congénères confinés seront directement en contact avec les virions excrétés.
Le taux d’évolution des virus influenza aviaires est donc beaucoup plus important chez les volailles d’élevage que chez l’hôte naturel, représenté par les oiseaux sauvages.
En conclusion, les modes d’élevage actuels favorisent l’émergence et la propagation d’un certain nombre de maladies contre lesquelles il faut sans cesse lutter par des mesures de prophylaxie sanitaire et médicale.
Autres
Pour des raisons principalement économiques, les espèces domestiques ont fait l’objet de davantage d’études, avec, comme cibles : le porc, le cheval, le chat et plus récemment le chien.
Des affections respiratoires liées à la souche H3N8 (avec modifications moléculaires sur l’hémgglutinine), responsable de la grippe équine, ont touché des lévriers (mortalité d’un tiers de l’effectif atteint). L’hypothèse d’une transmission du virus des équins aux canidés, sans recombinaison, a été avancée.
Les mammifères sont des hôtes accidentels au même titre que les oiseaux d’élevage. Chez eux, on ne connaît qu’un nombre limité de sous–types viraux.
Responsabilité partagée : les facteurs humains
Bien que réservoir naturel du virus influenza A, aucune preuve scientifique n’étaie l’hypothèse du rôle prépondérant des oiseaux sauvages dans la propagation du virus actuel. Pour les personnes qui font des raccourcis un peu hâtifs, vouloir tous les détruire pour éradiquer la maladie n’est pas la solution ! Comme l’indique le vieil adage : « la peur engendre l’erreur ».
Pour exemple, lorsque le virus se déplace vers l’Ouest, pour atteindre la Russie, les oiseaux sauvages ne peuvent être accusés car cet itinéraire ne correspond à aucun axe migratoire. De même, au Nigeria, la relative proximité des zones de marais, même si elle ne permet pas d’écarter la responsabilité des oiseaux migrateurs, n’autorise pas à les incriminer dans l’apparition du virus. Selon Emmanuel CAMUS, directeur du département d’élevage et médecine vétérinaire du CIRAD (Centre de coopération internationale en recherche agronomique pour le développement), l’introduction illégale de poussins d’un jour, en provenance de Turquie ou de Chine, demeure plus plausible dans la survenance de la grippe aviaire.
Lors de l’épisode (1997-2003) de la « grippe du poulet » à Hong Kong, la source du virus H5N1 provenait de volailles domestiques. Rappelons qu’en dehors des oiseaux, le virus est susceptible d’être transporté passivement par tout animal, personne ou moyen de transport. Les marchés d’oiseaux vivants, les déplacements des travailleurs du secteur de la volaille d’élevage, le transport des volailles domestiques et les combats de coqs sont des vecteurs plus probables dans la propagation de la maladie d’un pays à l’autre et d’une ferme à l’autre.
De plus, lors d’embargos décidés par les Etats sur les importations en provenance de pays où la grippe aviaire a été décelée, le principal danger vient des trafics d’oiseaux organisés pour contourner les interdictions. Les importations illégales, en Europe, d’animaux provenant de Thaïlande sont déjà à déplorer (ex d’aigles contaminés et retrouvés à l’aéroport de Bruxelles dans les bagages d’un passager). Le marché noir n’est pas une nouveauté ; au niveau mondial, le trafic d’animaux se positionne à la troisième place. Les restrictions et les interdictions favorisent le développement de marchés parallèles, qui échappent alors à tout contrôle sanitaire.
Et que dire des journalistes qui ne prennent aucune précaution sanitaire pour filmer l’intérieur des élevages, alors qu’ils arrivent tout droit des zones humides où l’on a découvert le ou les oiseaux sauvages supposés contaminés ?
Exemple de perturbation écologique
En Chine, les porcs et les canards sont élevés très près les uns des autres. Les canards sont placés dans des cages au-dessus des porcs et les porcs se nourrissent en grande partie des fientes d’oiseaux (chez l’oiseau, le virus se réplique dans l’épithélium intestinal alors qu’il se réplique dans l’épithélium respiratoire chez les mammifères).
Aberrations comportementales « humaines »
Dans le même temps qu’elles dénonçaient la responsabilité des oiseaux migrateurs dans la propagation de l’influenza, les autorités sanitaires de certains pays asiatiques ont menacé de réserver à l’avifaune sauvage le même sort qu’aux volailles domestiques. Les instances thaïlandaises ont tué des cigognes à bec ouvert et ont coupé les arbres où elles nichaient. À Singapour, l’administration a discuté, en place publique, de la possibilité de tuer corneilles et martins, espèces qui ne migrent pas. La capture des oiseaux sauvages afin de leur tailler les ailes a également été envisagée. Au Vietnam, des personnes paniquées ont libéré leurs oiseaux de compagnie tandis qu’en France, les abandons massifs de chats, après l’annonce de la contamination d’un chat allemand par le H5N1, ont été déplorés.
En résumé, le facteur humain est prépondérant dans la propagation d’une maladie, quelle qu’elle soit.
Et la notion de zoonose, dans tout ça ?
Une zoonose est une maladie transmissible de l’animal à l’homme ou de l’homme à l’animal.
La grippe humaine est-elle transmissible aux animaux ?
Enfin, des anticorps correspondant à des virus humains ont également été trouvés dans des sérums de porcs, de chevaux, de volailles… mais aussi bovins, moutons, chiens et chats, signes que ces animaux ont été en contact avec les souches humaines.
Les grippes animales sont-elles transmissibles à l’homme ?
L’homme est réceptif, assez exceptionnellement sensible aux virus grippaux animaux ou tout au moins à certaines souches de ces virus.
En conclusion, les grippes humaines et animales sont d’authentiques zoonoses.
2006 : Procédure lors de la découverte d’un oiseau mort
Faune sauvage
Si vous découvrez un ou plusieurs oiseaux morts, vous ne devez pas les toucher et avertir l’un de ces organismes (coordonnées concernant les Landes, département du siège de l’association), en précisant le lieu et si possible l’espèce :
1. L’office national de la chasse et de la faune sauvage au 05 58 91 92 92
2. Direction Départementale des Services Vétérinaires au 05 58 06 69 00
3. Préfecture des Landes au 05 58 06 58 06
Si sont découverts au moins 5 oiseaux morts de la même espèce, dans un périmètre de 500 m et sur une période de 7 jours, les animaux sont acheminés jusqu’au laboratoire départemental vétérinaire pour y pratiquer une autopsie.
Les oiseaux d’eau doivent être systématiquement autopsiés.
Si l’autopsie ne permet pas d’établir une cause évidente de la mortalité (naturelle, accident, empoisonnement, électrocution sur une ligne haute tension, chasse…), des prélèvements sont effectués et envoyés, dans un délai de 48 heures, vers un laboratoire agréé pour les recherches virales, dans le but d’un dépistage de grippe aviaire.
Oiseaux domestiques
Malades ou morts, le propriétaire doit appeler son vétérinaire qui pratiquera l’examen clinique ou l’autopsie des animaux. Selon les symptômes ou lésions constatées, il contactera la DSV (Direction des Services Vétérinaires).
Risque de pandémie ?
Il est important de ne pas faire d’amalgame entre l’influenza aviaire et les risques de pandémie grippale humaine.
Différence entre pandémie et épidémie
Une pandémie et une épidémie se définissent toutes deux comme une forte augmentation dans l’espace et dans le temps des cas d’une maladie. La différence se situe dans l’étendue et la gravité du phénomène : la pandémie s’accompagne d’un nombre important de cas graves et d’une mortalité élevée, dans plusieurs pays, simultanément.
Le déclenchement d’une pandémie est très rare. Cet événement serait lié à l’apparition d’un nouveau virus de la grippe, devant répondre simultanément à un certain nombre de conditions :
- la transmission d’homme à homme. Cela nécessite de partager des caractères et des gènes avec les virus grippaux humains. L’adaptation du virus à l’homme doit donc être reproductible à tous les virions. Cette étape correspond au dernier niveau avant la phase pandémique.
- être antigéniquement complètement nouveau pour l’homme de telle sorte que ce dernier ne disposerait d’aucune immunité protectrice (défenses naturelles). Cela nécessite un réassortiment avec un virus non humain.
- l’acquisition de facteurs de virulence qui doivent ensuite être conservés (maintenus).
Ces conditions ne peuvent être réunies qu’à la suite d’une cassure antigénique (cf. paragraphe sur les mutations), ce qui nécessite la co–infection d’une cellule par deux virus différents. Toutes les combinaisons (issus des réassortiments génétiques) ne satisfaisant pas à ces critères représentent des impasses pour le virus.
La probabilité que de telles recombinaisons perdent en pathogénicité est supérieure à celle qu’elles n’en gagnent. Le virus influenza n’a nul besoin de la grippe aviaire à H5N1 pour se transformer en un virus susceptible d’entraîner la forme maligne ou suraiguë de la grippe. Et la contamination inter–humaine n’a nul besoin des oiseaux aujourd’hui : les échanges et les voyages sont largement suffisants pour assurer la propagation d’une pandémie inter–humaine.
En 1994, une étude s’est intéressée à l’infection de 2 enfants aux Pays–Bas par des virus porcins. L’analyse moléculaire de ces derniers a révélé qu’ils résultaient du réassortiment de virus humains dont ils portaient les antigènes de surface H3 et N2 et de virus aviaires dont ils contenaient toutes les autres protéines. Cette infection n’a pas été suivie d’épidémie. A cela, deux raisons possibles :
- les antigènes de surface appartenaient à des types moléculaires qui avaient déjà circulé chez l’homme ; le virus n’était donc pas complètement nouveau
- les gènes codant pour les caractères adaptatifs aux cellules de l’espèce hôte étaient d’origine aviaire, entraînant une moins bonne compatibilité chez l’homme.
On ne connaît pas les doses infectieuses chez l’homme car il est difficile d’envisager des études expérimentales humaines.
Remarques
L’OMS (Organisation Mondiale de la Santé) estime à plusieurs millions le nombre de personnes ayant été en contact avec des animaux malades. Parmi celles-ci, en 2006, « seules » 170 personnes sont mortes de la maladie, dont la majorité n’a pas eu un accès immédiat aux soins (méconnaissance des risques/symptômes, isolement géographique…).
La transmission du virus de la grippe aviaire est donc rare et à chaque cas avéré, ces infections se sont produites dans un contexte très particulier : proximité, travail et manipulation des poulets vivants. Aujourd’hui, les personnes susceptibles d’être exposée à la grippe aviaire sont les éleveurs, les techniciens d’abattoir, les vétérinaires et les laborantins. Il s’agit donc d’un risque professionnel.
L’exemple le plus éclatant de contamination directe de l’homme par des virus aviaires avec apparition d’un syndrome grippal fut celui dit de la « grippe du poulet » qui s’est déroulé à Hong Kong en 1997. Il n’a cependant pas été le prélude à une pandémie.
Le spectre de la grippe espagnole plane sur nos subconscients. D’autres pandémies ont pourtant eu lieu depuis. Nous ne sommes plus en 1918, avec des différences aussi bien positives : avancées scientifiques (méthodes d’identification par typage génétique…), médecine incluse (accès aux soins, du moins pour les pays développés…) que négatives (mondialisation des transports et donc intense brassage des populations renforçant la circulation des agents pathogènes…).
Enfin, pour clore ce chapitre, rappelons que, selon l’OMS (Organisation Mondiale de la Santé), 10 à 20 % de la population mondiale contracte la grippe chaque année, à l’origine de 250.000 à 500.000 morts.
Tiens, c’est bizarre…
En France, en 2006, les volailles ont dû être confinées. Afin de respecter un label de qualité, certains départements ont eu droit à une dérogation. Les 3 départements concernés étaient les Landes, la Loire-Atlantique et la Vendée. Suite à la campagne obligatoire de vaccination contre le H5N1, seules les Landes sont restées en lice. Cette campagne de vaccination concernait les élevages des communes situées en zone humide. D’après les autorités, voici donc les zones intéressées.
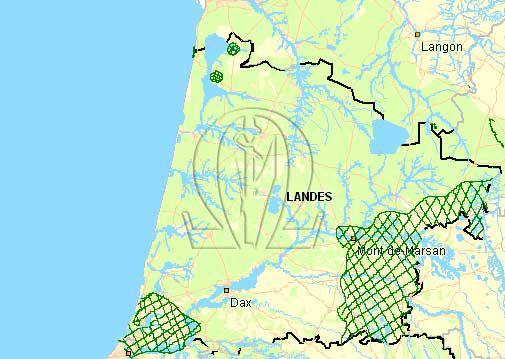
Carte de vaccination
Les zones hachurées en vert délimitent ces zones de vaccination, donc normalement corrélées à la présence des zones humides.
Il n’est besoin d’être un scientifique de haut niveau pour s’apercevoir que le département des Landes regorge de zones humides. Rappelons qu’il n’y a pas si longtemps, il s’agissait d’une zone marécageuse…
Environ les ¾ des élevages se situent au sud de l’Adour, grande rivière qui relie Dax à Mont-de-Marsan (Sud Landes). Le quart restant est disséminé au nord.
Par ailleurs, les Landes se situent sur le couloir de migration Atlantique Est des oiseaux.
Alors ?
Une fois de plus, en matière de faune sauvage, les décisions politiques ne tiennent pas compte de la réalité du terrain. Quelles conséquences au niveau sanitaire alors que tout le monde craint une pandémie ?
Définitions
Contagiosité : se définit par la capacité d’un virus ou d’un agent infectieux à être transmis d’un individu à un autre.
Illustration : le rhume est dû à un virus très contagieux peu virulent (guérison spontanée). Inversement, certaines méningites virales, parfois sévères, sont dues à des virus qui ne sont pas contagieux.
Antigène : toute substance susceptible de provoquer la production d’anticorps.
Epidémiologie : étude des facteurs de santé au sein d’une population. Le point de départ est l’observation, elle ne concerne donc pas les théoriciens. Le but de l’épidémiologie est de parvenir à des mesures de lutte, de prévention, et à la mise en place de barrières sanitaires.
Epizootie : épidémie atteignant les espèces animales.
On parle d’épizootie de grippe aviaire lorsque cette maladie affecte brutalement un grand nombre d’animaux à la fois dans une région donnée.
Virus de la grippe A/H1N1 (« porcine », mexicaine)
Article Le Monde.fr : Didier Raoult travaille à l’Institut fédératif de recherche 48 à Marseille. Auteur des Nouvelles Maladies infectieuses (PUF), il estime que la France ne dispose pas, aujourd’hui, des « structures adéquates » pour lutter contre une épidémie de grippe porcine.
Pourquoi le virus de la grippe porcine est-il apparu au Mexique ?
Ce n’est pas parce que le virus de la grippe porcine est apparu au Mexique qu’il y est né. Plusieurs souches de virus, capables de se recombiner entre eux (échanger leur gènes) et de muter, circulent à travers le monde. Ils peuvent émerger n’importe où. Le plus gros réservoir se trouve aujourd’hui en Asie, dans le sous-continent indien et en Chine. Souvent, les premiers mutants de virus apparaissent dans les élevages de volailles de cette région. Les oiseaux et les cochons cohabitent souvent dans les mêmes basse-cours. A force de promiscuité, certains virus finissent donc par s’adapter aux porcs. La transmission à l’homme est alors facilitée, parce que nos défenses immunitaires sont plus proches de celles du cochon que de celles des oiseaux. Le risque d’avoir un mutant transmissible d’homme à homme est donc plus important à partir d’une infection par un virus porcin. C’est beaucoup plus inquiétant d’avoir une épidémie porcine qu’une épidémie aviaire.
Comment se propage un virus comme celui de la grippe porcine ?
Il y a trois étapes : d’abord, l’épidémie qui se déclenche chez les animaux (l’épizootie), puis la transmission de l’infection de l’animal à l’homme (la zoonose), enfin l’épidémie inter-humaine.
Le virus de la grippe aviaire n’a jamais vraiment passé le stade de la zoonose. La grippe porcine, par contre, se développe aujourd’hui par transmission d’homme à homme. Reste à connaître le ratio de transmissibilité du virus, c’est-à-dire son degré de contagiosité. Pour les maladies infectieuses respiratoires, une personne malade transmet en moyenne le virus à deux personnes. Ce taux est de vingt-trois pour un avec la rougeole.
En fonction du taux de contagiosité, le virus peut se multiplier à une vitesse exponentielle. Près d’un milliard de personnes prennent l’avion chaque année. Une étude allemande a démontré que 72 % des passagers attrapent un virus respiratoire lors d’un vol de plus de quatre heures. La dernière épidémie de grippe humaine qui a suivi une grippe porcine a fait deux millions de morts : c’était la grippe asiatique en 1957.
Que se passe-t-il quand le virus mute ?
C’est beaucoup plus difficile de connaître le taux de transmission une fois que le virus a muté. Chaque mutant a son propre génie dynamique, sa propre capacité à se multiplier. Ça devient très compliqué de faire des prédictions. Les modélisations sont toujours basées sur des analyses rétrospectives qui négligent une chose : les vivants sont toujours différents. Les médicaments dont nous disposons aujourd’hui sont efficaces s’ils sont prescrits très tôt. C’est beaucoup plus compliqué quand les gens deviennent contagieux.
Comment peut-on lutter contre ces virus mutants qui se transmettent d’homme à homme ?
La France est très en retard en ce qui concerne la lutte contre les infections respiratoires. Ne serait-ce que pour la grippe traditionnelle… Il existe aujourd’hui un vaccin et la plupart des gens sont immunisés contre le virus. Pourtant, c’est une maladie qui fait en moyenne 5 000 ou 6 000 morts par an en France. Les personnes âgées et les nouveaux-nés sont les plus touchés, mais tout le monde est exposé. Le jour où apparaîtra un mutant grippal dont la population n’est pas protégée par la vaccination, ce sera un désastre. Nous n’avons pas aujourd’hui les structures adéquates et nous connaissons mal les conditions de transmission.
Quels sont les pays les plus armés pour résister à ce genre d’épidémie ?
Les plus avancés sont les Chinois. Pour juguler l’épidémie de SRAS (syndrome respiratoire aigu sévère), ils ont construit un hôpital doté de 600 lits à l’isolement et développé des services pour la prise en charge des malades contagieux. En Italie, il y a deux hôpitaux avec des dispositions similaires. En France, nous ne sommes mêmes pas capables d’enrayer des épidémies comme la gastro-entérite et la grippe traditionnelle.
Propos recueillis par Elise Barthet
Vigilance et mobilisation dans le monde
Le comité d’urgence convoqué, samedi 25 avril 2009, par l’Organisation mondiale de la santé a conclu que l’apparition d’un virus de
la grippe porcine transmissible d’homme à homme représentait une « urgence en terme de santé publique et une préoccupation internationale ». En vertu de cette conclusion, la directrice générale de l’OMS, Margaret Chan, « a recommandé (…) que tous les pays intensifient leur surveillance de tous les cas inhabituels de maladie ressemblant à une grippe ou à une grave pneumonie ».
La menace de la grippe porcine semble désormais s’étendre, avec de nouveaux cas suspects détectés à travers le monde, tandis qu’au Mexique, où elle aurait déjà fait plus de 150 morts, les autorités renforçent les mesures pour stopper l’épidémie. Un peu plus de 1300 patients sont en observation, toujours selon les autorités, qui avaient rassuré sur la disponibilité du médicament antiviral actif contre le virus, préféré à la vaccination massive d’abord envisagée.
La souche A/H1N1 détectée sur les douze premiers cas mortels mexicains est « génétiquement identique » à celle découverte en Californie aux Etats-Unis, a précisé l’OMS.
Contrairement aux infections causées par le virus de l’influenza saisonnier qui touche habituellement les enfants et les personnes âgées, ce sont les jeunes adultes en bonne santé qui ont été le plus affectés.
Ce type de virus de la grippe H1N1, (à ne pas confondre avec le H5N1 de la grippe aviaire), n’a jamais été observé auparavant dans le monde. C’est la première fois que les chercheurs découvrent une souche aviaire, deux souches porcines et une souche humaine au sein du même virus. Les experts du Center for Disease Control (CDC) croient que la souche H1N1 contenue dans le vaccin contre la grippe actuel n’est probablement pas efficace contre le nouveau virus de la grippe porcine. Ce nouvel H1N1 résiste aux antiviraux amantadine et rimantadine, mais est sensible à des molécules plus récentes, tels que l’oseltamivir et le zanamivir.
Le ministère français de l’Agriculture rappelle que cette grippe d’origine porcine au Mexique « ne s’attrape pas en mangeant de la viande, mais par voie aérienne, d’homme à homme ». La température de cuisson détruit virus et bactéries.
Pour les scientifiques, trois scénarios sont possibles. Le plus rassurant serait que l’épidémie s’arrête (possibilité d’extinction du virus grâce aux mesures prises par les populations pour le freiner). Autre possibilité : la persistance de cas sporadiques dans certaines zones géographiques, comme on l’a vu pour le virus de la grippe aviaire (d’où l’importance de repérer les cas et de les isoler, de manière à casser la chaîne de l’épidémie). Enfin, dernière hypothèse : le virus s’étend dans le monde et évolue en pandémie.
Lundi 27 avril 2009, le niveau d’alerte à la pandémie de grippe est passé de la phase 3 à la phase 4. Le passage à une phase d’alerte pandémique supérieure signifie que la probabilité d’une pandémie a augmenté, mais non qu’une pandémie est inévitable.
Source : Avec AFP/OMS
Diagnostic et recommandations de prise en charge
Comme le tableau clinique classique de l’infection par le virus de la grippe porcine chez l’homme ressemble à ceux de la grippe saisonnière et d’autres infections des voies respiratoires supérieures, la plupart des cas ont été dépistés par hasard à l’occasion de la surveillance de la grippe saisonnière. Des cas bénins ou asymptomatiques peuvent être passés inaperçus et c’est pourquoi on ignore quelle est l’étendue réelle de la maladie chez l’homme.
En général, les gens contractent la grippe porcine à partir de porcs infectés, mais certains cas répertoriés chez l’homme ne montrent aucune notion de contact avec des porcs ou des environnements où des porcs auraient séjourné. Il y a eu transmission interhumaine dans quelques cas mais elle a été limitée aux contacts proches ou à des groupes fermés.
Une personne présentant un syndrome respiratoire aigu brutal (signes généraux : fièvre > 38° ou courbatures ou asthénies et signes respiratoires : toux ou dyspnée) devient un cas possible si dans les 7 jours avant le début de ces signes :
1. elle a séjourné en Californie dans les comtés de San Diego ou Imperial (sud de la Californie).?
2. elle a séjourné au Texas dans le comté de San Antonio (près de la frontière mexicaine).?
3. elle a séjourné au Mexique dans le district fédéral de Mexico city ou de San Luis Potosi ou de Baja Californie ou de Oaxaca?
4. elle a eu un contact étroit avec un cas possible, probable ou confirmé dans les 24h avant le début des signes.
Les personnes qui répondent aux critères de la définition de cas possible, ci-dessus, doivent contacter le centre 15.
Il est recommandé d’hospitaliser dans l’établissement le plus proche les cas possibles avec mise en œuvre d’isolement respiratoire et d’un traitement par un inhibiteur de la neuraminidase, en attente d’une confirmation ou d’une infirmation biologique du diagnostic de grippe.
Les contacts étroits des cas possibles doivent rester à domicile et éviter les contacts avec des personnes extérieures. En cas d’apparition de fièvre ou de signes respiratoires, ils doivent contacter le centre 15 pour une évaluation de leur situation.
Ces recommandations sont susceptibles d’évoluer en fonction de l’évolution de la situation et des informations disponibles.
Pour les personnes qui séjournent actuellement au Mexique ou doivent s’y rendre dans les prochains jours, des informations sont disponibles sur le site du Ministère des Affaires étrangère
Contactez le 15 ou consultez votre médecin traitant si vous percevez les symptômes suivants dans les 7 jours qui suivent votre retour de zones à risque : fièvre – toux – courbatures – fatigue.
Source : InVS, OMS et ministère de la Santé
Un médicament contre la grippe porcine
Il n’existe aucun vaccin renfermant le virus grippal porcin actuel à l’origine de la maladie chez l’homme. On ignore si les vaccins contre la grippe saisonnière peuvent conférer une protection. Les virus grippaux évoluent très rapidement. Il est important de mettre au point un vaccin contre la souche virale qui circule actuellement, de façon qu’il confère une protection maximum aux sujets vaccinés. C’est pourquoi l’OMS doit avoir accès au plus grand nombre de virus possible pour pouvoir sélectionner le virus vaccin candidat approprié.
Des antiviraux contre la grippe saisonnière sont disponibles dans certains pays et ils permettent de prévenir et de traiter efficacement cette maladie. Il existe deux classes d’antiviraux : 1) les adamantanes (amantadine et rémantadine) et 2) les inhibiteurs de la neuraminidase des virus grippaux (oseltamivir et zanamivir).
La plupart des cas de grippe porcine précédemment notifiés ont montré un rétablissement complet sans assistance médicale ni antiviraux.
Certains virus grippaux développent une résistance aux antiviraux, limitant l’efficacité de la chimioprophylaxie et du traitement.
Les virus obtenus à partir des cas de grippe porcine récemment dépistés chez l’homme aux États-Unis d’Amérique étaient sensibles à l’oseltamivir et au zanamivir mais résistants à l’amantadine et à la rémantadine.
On ne dispose pas de suffisamment d’informations pour pouvoir faire des recommandations sur l’utilisation des antiviraux dans la prévention et le traitement de l’infection par le virus grippal porcin. Concernant la flambée en cours d’infection par le virus grippal porcin sévissant aux États-Unis et au Mexique, les autorités nationales et locales recommandent d’utiliser de l’oseltamivir ou du zanamivir pour le traitement et la prévention de la maladie en se basant sur le profil de sensibilité du virus.
Depuis l’épidémie de grippe aviaire, la France s’est constitué un stock important de médicaments anti-viraux pour traiter les malades en cas d’extension du virus sur notre territoire. Aujourd’hui 33 millions de doses d’oseltamivir et de zanamivir seraient stockées dans des sites tenus secrets. Ces médicaments sont efficaces contre tous les virus grippaux connus à ce jour. En effet, malgré les mutations, l’oseltamivir a pour particularité d’agir sur une partie constante du virus.
Source : Organisation Mondiale de la Santé (OMS)

